お問い合せフォーム からお問い合わせください。折り返し弊社担当よりご連絡いたします。
- 検体採取方法、検査のスケジュール、価格などのご説明
- ご契約
- 当社システムのログイン情報の発行
- 検体キット・検査案内のご送付
- 検査開始
ご希望の場合はオンラインでのご説明・勉強会なども承ります。
検査のご依頼
検査のご依頼に際しましては、弊社の検査受託システムをご使用ください。
検査概要
| 検査項目名 | β2GPIネオセルフ抗体検査 |
|---|---|
| 検査項目コード | F001 |
| 検査方法 | Flow Cytometry (FCM法) |
| 検査実施場所 | ネオセルフ抗体検査センター |
| 材料 | 血清 1mL |
| 容器 | 専用容器  凝固促進剤入り採血管にて採血後、1500G・10分間遠心分離し、弊社指定返送キット備え付けの専用容器へ血清を1mL分注してください。 |
| 保存温度/安定性 | 冷蔵 / 2週間 |
| 所要日数 | 検査測定場所到着後5〜15営業日程度 |
| 基準値 | 73.3(U)未満 |
ネオセルフ抗体検査とは
自己免疫疾患とは免疫系が正常に機能しなくなり、自分自身の持つ抗体等の免疫系が、自分の組織の抗原となるタンパク質を標的として攻撃してしまう病気です。ネオセルフ抗体とは、自己抗原となるタンパク質が病気のなりやすさと関わるヒト白血球抗原クラスⅡ(HLA-DR)というタンパク質と結合して出来る複合体を攻撃し、自己免疫疾患を引き起こす抗体のことを言います。
新しい(「ネオ」)考え方に基づく自己抗原(「セルフ」)に対する抗体なので、ネオセルフ抗体と名付けられました。
検査方法(FCM法)
蛍光色素で標識した抗体で染色した細胞を高速度で流しながらレーザー光を照射し、前方散乱(細胞の大きさ)、側方散乱(細胞の内部構造)と蛍光強度(細胞表面の対応抗原)から個々の細胞を解析する方法です。
原理
APSの原因となっている自己タンパクであるβ2GPIと病気になりやすいHLA-DRを利用した画期的な技術に基づいています(特願2015-527186)
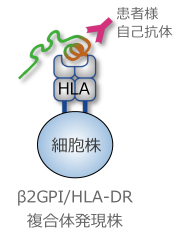
- 遺伝子導入によりβ2GPIおよびHLA-DRを所定の細胞株に導入し、β2GPI/HLA-DR複合体(ネオセルフ抗原)を細胞表面に発現させます。
- 患者様血清とネオセルフ抗原を反応させ、抗ネオセルフ自己抗体価を測定します。
- ネオセルフ抗原で提示されるエピトープは、従来法では検出されない自己抗体と結合することができ、病態をより正確に反映する検査が可能になりました。
この検査について
β2GPIネオセルフ抗体検査は、「不育症管理に関する提言2021」(令和2年度厚生労働科学研究費補助金 成育疾患克服等次世代育成基盤研究事業)において、研究的検査として位置づけられています。
AMED 研究班による多施設共同の前向き研究によって、ネオ・セルフ抗体(抗β2GPI/HLA-DR 抗体)が不育症女性の 23%に、原因不明不育症女性の 20%で陽性になることが世界で初めて明らかになり、不育症の新たな原因・リスク因子である可能性が示された(Tanimura K, et al. Arthritis Reumatol. 2020;2(11):1882-1891)。現在、治療法や産科異常との関連性を調べるための多施設共同前向き研究が進行中である。
不育症管理に関する提言2021
提言改訂委員会の議論では、わが国から発信されたエビデンスがあり、複数の国内検査機関が受注を開始していることもあり選択的検査に入れるべきとの意見も出たが、抗PE 抗体などに比べるとエビデンスが限定されており、提言 2021 では研究的検査としエビデンスの蓄積を待つこととした。
お問い合わせ
製品・サービスに関するご質問は以下の問い合わせフォームよりご連絡ください。
